Lun-Ven: 8.00/13.00 - 16.00/18.30 Vedi tutti
- +39 0872 49877
-
Questo indirizzo email è protetto dagli spambots. È necessario abilitare JavaScript per vederlo.
Toxoplasmosi: overview dell'infezione congenita
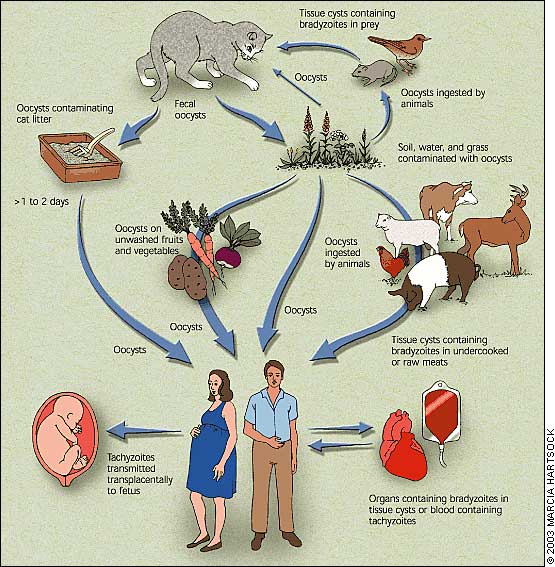
È una malattia infettiva a diffusione ubiquitaria, provocata da Toxoplasma gondii, protozoo che parassita frequentemente numerosi animali selvatici e domestici ed occasionalmente l’uomo nel quale determina spesso infezioni a decorso inapparente e talvolta malattia connatale o raramente acquisita.
Aspetti etio-epidemiologici
T. gondii appartiene ai coccidi e nella fase di tachizoite (trofozoite ad alta replicazione), ha una lunghezza di 4-7 micron, forma semilunare ad arco, si muove per rotazione attorno al proprio asse, e si moltiplica per scissione binaria all’interno degli elementi cellulari; alla colorazione con Giemsa, il nucleo appare rosso violetto ed il citoplasma azzurrino o blu pallido.
Ha come ospite definitivo il gatto e come ospite intermedio diversi animali (mammiferi, uccelli etc.) compreso l’uomo. Il gatto è un anello importante nella diffusione dell’infezione in quanto soltanto nel suo intestino si svolge il ciclo sessuato del protozoo.
Pervenuto nell’intestino del felino, in seguito all’ingestione di animali infestati, T. gondii si moltiplica a livello delle cellule epiteliali della mucosa intestinale inizialmente per scissione binaria (come negli altri animali) dando luogo alla formazione di merozoiti, successivamente la maturazione delle difese immunitarie ostacola questa attività invasiva e inibisce la replicazione schizogonica, il che comporta uno switch ad un ciclo sessuato con formazione di microgameti, macrogameti ed oocisti che vengono eliminate nel terreno con le feci. Le oocisti nel volgere di alcuni giorni sporulano e danno origine a due sporocisti contenenti ciascuna quattro sporozoiti. Portate in superficie dai vermi e disseminate nel terreno, le oocisti costituiscono una importante e subdola fonte di infezione per gli animali e per l’uomo.
Le sporocisti si mantengono vitali per diversi mesi, ma vengono uccise dalla bollitura. Ingerite dall’uomo o da altri animali, a livello gastrico liberano gli sporozoiti che si trasformano in tachizoiti che attraversano lo strato epiteliale della mucosa intestinale, si moltiplicano per schizogonia, e attraverso i linfatici e la via ematica si diffondono in tutto l’organismo dove continuano a replicare prevalentemente a livello delle cellule del SRE dando luogo a lesioni degenerativo-necrotiche. Con lo sviluppo dell’immunità specifica la circolazione dei toxoplasmi gradualmente si riduce, e i tachizoiti si trasformano in bradizoiti (trofozoiti a lenta replicazione) morfologicamente simili, ma più piccoli e che per un processo di endoduogenia (una sorta di gemmazione interna) replicano all’interno del protozoo originario formando così una cisti contenente centinaia di bradizoiti, delle dimensioni di 30-150 ïm protetta da una robusta membrana elastica, che si ritrova nei muscoli e nel cervello di molti mammiferi e uccelli (vedi foto in bianco e nero); all’interno di tali cisti, i bradizoiti possono sopravvivere per anni in uno stato di latenza, al riparo dagli anticorpi ematici. Quando i tessuti che contengono le cisti vengono ingerite da un ospite intermedio carnivoro (occasionalmente l’uomo), i processi digestivi liberano i bradizoiti che si trasformano in tachizoiti e provocano un’infezione acuta, se invece vengono ingeriti dal gatto danno origine a livello dell'epitelio intestinale ad un ciclo replicativo asessuato seguito da uno sessuato.
Toxoplasmosi acquisita acuta
L’uomo contrae l’infezione quindi o ingerendo le oocisti sporulate (acque o alimenti contaminati, contatti con gatti o loro escrementi.) o le cisti (presenti in carni poco cotte); è stata documentata anche la trasmissione per trasfusione di sangue o di emoderivati o per trapianto d’organo o di midollo.
Il periodo di incubazione è di circa 7 giorni (range 4-21giorni).
Negli adulti e nei bambini immunocompetenti la malattia è generalmente asintomatica, talvolta si manifesta con una linfadenite, i linfonodi modicamente aumentati di volume, non (o poco) dolenti alla palpazione, di consistenza duro-elastica, non aderiscono né ai piani superficiali né a quelli profondi, e non tendono a confluire, a suppurare o a fistolizzare; più stazioni linfatiche sono in genere interessate, talvolta solo i linfonodi laterocervicali, i suboccipitali o gli ascellari, ma tutti i linfonodi, anche quelli profondi (mediastinici, mesenterici, retroperitoneali) possono essere coinvolti. La linfadenite spesso è accompagnata da sintomi sistemici quali febbricola, astenia, anoressia, fugaci rash maculopapulosi e una modesta epatosplenomegalia. Gli esami ematochimici evidenziano una linfomonocitosi con elementi atipici simili a quelli della mononucleosi infettiva ed un lieve incremento delle transaminasi. Nell’1 % dei casi si ha una corioretinite monolaterale. Raramente sono state descritte manifestazioni più gravi quali: epatite, polmonite, miocardite, pericardite, meningoencefalite.
La diagnosi è fondamentalmente sierologica: la presenza di IgG specifiche, se accompagnata dalla presenza di titoli anche bassi di IgM e di IgA o di IgE, è dimostrativa di un’infezione acuta recente; l’assenza di IgM, di IgA o di IgE esclude la diagnosi di infezione acuta.
La ricerca delle IgA, che decadono prima delle IgM è utile per datare l’infezione nelle donne gravide, infatti le IgM possono persistere per 6-9 mesi (talvolta fino a 2 anni) dopo l’infezione. A tale scopo si sono rilevati utili anche il test delle IgG avidity in ELISA (anticorpi IgG con alta avidità compaiono nel siero entro 6 mesi dall’infezione), ed il test dell’agglutinazione differenziata che utilizza come antigeni due popolazioni di toxoplasmi: uno fissato con acetone, l’altro cono formalina.
Le tecniche sierologiche più valide per determinare le IgM, IgA ed IgE sono i test di immunoadsorbimento-agglutinazione (ISAGA) e l’ELISA-DS (doppio sandwich).
Terapia del bambino e dell’adulto immunocompetente
La toxoplasmosi acquisita acuta dell’adulto immunocompetente si risolve in genere spontaneamente senza alcun trattamento, solo nei casi più gravi viene prescritta l’associazione pirimetamina-sulfadiazina; la pirimetamina alla dose di 1mgKg/die (max 25 mg/die) per os in unica somministrazione giornaliera, e la sulfadiazina 85-100 mg/Kg/die in 4 somministrazioni (max 8 g/die) per 3-6 settimane. È bene associare l’acido folinico per evitare gli effetti ematologici tossici. Nei casi di intolleranza alla sulfadiazina, al suo posto può essere adoperata la clindamicina alla dose di 30 mg/Kg (max 300mg/die) in 4 somministrazioni per os.
Terapia della donna in gravidanza
In qualsiasi fase della gravidanza, la donna abbia contratto l’infezione da T. gondii, essa, deve essere trattata; un corretto trattamento riduce del 60% la possibilità di una infezione congenita, inoltre nei casi di infezione riduce la gravità della malattia nel neonato.
-
Durante il primo trimestre di gravidanza a causa della potenziale teratogenicità della pirimetamina, dovrebbe essere utilizzata la spiramicina alla dose di 3-4 g/die in 3 somministrazioni orali a digiuno
-
successivamente per tutto il resto della gravidanza si procede con l’associazione pirimetamina-sulfadiazina; la pirimetamina alla dose di 1mgKg/die (max 25 mg/die) per os in unica somministrazione giornaliera, e la sulfadiazina 85-100 mg/Kg/die in 4 somministrazioni (max 8 g/die) ricordandosi di associare sempre l’acido folinico.
Le donne in gravidanza con sierologia negativa per T. gondii devono:
-
Evitare il contatto con i gatti
-
Lavare bene vegetali e frutta
-
Evitare la contaminazione dei cibi da parte di mosche e scarafaggi
-
Cuocere la carne a 66°C prima del consumo (le carni affumicate e congelate sono considerate sicure)
Toxoplasmosi congenita
è dovuta al passaggio transplacentare dei tachizoiti in seguito ad un’infezione materna contratta durante la gravidanza; la sieroconversione durante la gravidanza si verifica in percentuali variabili fra lo 0,2 ed il 4% nelle diverse aree geografiche. La prevalenza in Italia è di circa 3 casi per 1000 nati vivi.
La percentuale di trasmissione è in relazione diretta con l’età gestazionale al momento dell’infezione (17%, 25% e 65% nel 1°, 2°, e 3° trimestre di gravidanza rispettivamente); l’entità del danno fetale è invece tanto maggiore quanto più precoce è stata l’infezione della gestante. Queste differenze nella percentuale di trasmissione sono correlate al flusso sanguigno placentare, alla carica ed alla virulenza di T. gondii e alle capacità della madre di limitare la parassitemia. Il rischio per il feto non è correlato al fatto che l’infezione materna sia sintomatica o meno.
Le conseguenze della infezione congenita possono essere quindi diverse:
-
aborto;
-
morte fetale tardiva;
-
fetopatia manifesta, è dovuta a una diffusione pluriviscerale di tachizoiti, ha molto spesso un esito letale. Nel 25-50 % dei casi si ha nascita prematura di un neonato piccolo per l’età gestazionale e un basso punteggio di Apgar. La cute spesso presenta petecchie, ecchimosi o emorragie secondarie a trombocitopenia ed esantemi di varia morfologia spesso con elementi violacei. In base alla maggiore espressività della sintomatologia a carico dell’uno o dell’altro apparato si possono distinguere:
-
varietà epatitica con epatosplenomegalia, ittero marcato e manifestazioni emorragiche;
-
varietà polmonare dove predominano i sintomi a carico dell’apparato respiratorio (polipnea, cianosi), dovuti a focolai di polmonite interstiziale talvolta con essudato emorragico;
-
Varietà enterocolitica con diarrea muco-ematica e meteorismo
-
Varietà cardiovascolare con lipotimie e adinamia
-
Varietà encefalitica caratterizzata da una encefalopatia acuta massiva
-
forme subacute o latenti in cui l’infezione permane attiva al momento della nascita, specie a livello neuro-oculare; la manifestazioni principali sono la corioretinite e, meno frequentemente le convulsioni e il ritardo mentale e psicomotorio che si manifestano a distanza di mesi o anni dalla nascita;
-
La corioretinite – virtualmente tutti i soggetti con una infezione congenita non trattata andranno incontro a corioretinite in età adulta che in circa il 50% dei casi porterà ad una grave perdita del visus. Sono interessati generalmente entrambi gli occhi, è caratterizzata da lesioni multiple “a rosetta”, spesso in sede maculare o paramaculare, costituite da placche rilevate, pigmentate in periferia e spesso ulcerate al centro. Anche l’uvea anteriore può essere intensamente infiammata determinando eritema della camera anteriore dell’occhio.
-
forme croniche che rappresentano fondamentalmente le sequele di un processo ormai spento (in realtà i focolai neuro-oculari restano attivi) e sono caratterizzate da:
-
idrocefalo – è di tipo ostruttivo, il processo infiammatorio determina spesso l’occlusione del dotto di Silvio o dei forami di Monro. In genere è monolaterale e raramente assume dimensioni eccessive, ma determina un incremento sproporzionato della circonferenza cranica. L’idrocefalo può presentarsi nel periodo perinatale o, meno comunemente, presentarsi più tardivamente nel corso della vita
-
Calcificazioni intracraniche – prodotte dalla deposizione di sali di calcio nelle zone malaciche e del tessuto andato incontro a necrosi. Sono di numero e di dimensioni variabili, possono avere aspetto nodulare, a grano di miglio o lineari a colpo d’unghia. Si repertano con maggiore frequenza nelle regioni periventricolari (specialmente a livello subependimale e nei plessi corioidei) e a livello del nucleo caudato;
-
Sintomi di sofferenza neurologica – sono in genere di tipo ipercinetico e sono costituti da convulsioni generalizzate o circoscritte (possono manifestarsi nei primi giorni di vita, ma anche a distanza di mesi o anni), mioclonie, tremori a piccole onde che interessano soprattutto gli arti, opistotono e ipsaritmia. Talvolta si hanno segni di tipo ipocinetico con paresi o paralisi sia dei nervi cranici che di quelli spinali (paralisi delle estremità, difficoltà alla deglutizione, insufficienza respiratoria).
Il liquor cefalorachidiano nella maggior parte dei casi è xantocromico, mostra una spiccata iperproteinorrachia e una modesta pleiocitosi linfocitaria. Nel liquor può essere evidenziata la produzione di anticorpi specifici (può essere utile la seguente formula Ab liquor/conc gammaglob siero X Ab siero/ conc gammaglob nel liquor, un valore >4 è indice di produzione intratecale)
La microcefalia è in genere secondaria ad un grave insulto cerebrale, ma bambini alcuni bambini con tale segno, se adeguatamente trattati hanno un normale sviluppo.
-
danno oculare - microftalmia, glaucoma, cataratta, corioretinite, nevrite ottica, strabismo.
Aborto, morte fetale tardiva e fetopatia manifeste sono abbastanza rare, le forme subacute e le croniche sono le più frequenti, la corioretinite si può considerare una costante. La tetrade di Sabin dei vecchi clinici è costituita da: idrocefalo, calcificazioni cerebrali e corioretinite. Nel complesso l’infezione alla nascita è asintomatica nel 75 % dei casi in cui l’infezione è avvenuta nel secondo trimestre e nel 95 % dei casi in cui è avvenuta nel terzo trimestre.
La diagnosi prenatale si fonda sulla dimostrazione di una risposta anticorpale specifica in campioni di sangue fetale, e/o nella ricerca di T. gondii nei globuli bianchi del sangue fetale o nelle cellule del liquido amniotico o dalla placenta (coltura e PCR).
La sintesi delle IgM specifiche non è in genere evidenziabile prima delle 24 settimane di gestazione. La sintesi delle IgG specifiche non è prima del terzo mese di vita, ma se la gravida è stata adeguatamente trattata può essere molto ritardata (fin dopo la nascita).
Alterazioni aspecifiche che suggeriscono una infezione toxoplasmica sono: la conta dei bianchi, il numero degli eosinofili, i test di funzionalità epatica ed il dosaggio delle IgM totali (non specifiche) indagini ecografiche seriate (ogni 15 giorni).
Diagnosi post-natale
La diagnosi si basa sulla dimostrazione nel siero delle IgM, IgA o IgE specifiche, ma anche il riscontro di titoli persistentemente alti o in incremento di IgG può essere sufficiente (è importante rapportare il titolo delle IgG specifiche con quello delle IgG totali, tale rapporto aumenterà nel bambino infetto e si riduce in quello non infetto); così come è sufficiente un risultato colturale positivo o una PCR positiva (sempre che il laboratorio sia attendibile). Il test di blastizzazione dei linfociti nei confronti di antigeni di T. gondii può essere utile se persistono dubbi e gli altri test sono negativi (anche se in taluni casi è stata descritta una specifica anergia linfocitica).
La TAC cerebrale con mezzo di contrasto è utile per ricercare le calcificazioni, valutare le dimensioni dei ventricoli, rivelare lesioni infiammatorie attive e dimostrare eventuali strutture cistiche. Con l’ecografia transfontanellare possono essere monitorizzate le dimensioni dei ventricoli. Lesioni infiammatorie attive possono essere ricercate con TAC con m.d.c., RM, e con la scintigrafia cerebrale con radionuclidi.
Di fronte ad un neonato con sospetta toxoplasmosi connatale la diagnosi differenziale deve essere fatta con le altre infezioni provocate dagli agenti TORCH, con la sifilide connatale, con le sepsi neonatali, con le encefaliti e con l’eritroblastosi fetale. L’iperproteinorachia è un importante segno che depone per la diagnosi di toxoplasmosi connatale
Tab. Esami da eseguire alla nascita nei casi sospetti di toxoplasmosi connatale
-
visita oculistica,
-
TAC cerebrale,
-
coltura e/o la PCR per T. gondii nella placenta e nei globuli bianchi del sangue del cordone ombelicale
-
Dosaggio degli anticorpi sierici specifici di classe IgG, IgM, IgA e IgE (per gli ultimi 3 devono essere sempre utilizzate determinazioni in ELISA-DS o ISAGA)
-
Dosaggio delle IgM e delle IgG totali nel siero
-
Puntura lombare con conta cellule, dosaggio glicorrachia, proteinorrachia e dosaggio IgM, e IgG specifiche, coltura e PCR per T. gondii
Terapia della toxoplasmosi congenita
Devono essere trattati tutti i neonati infetti a prescindere dalla evidenza di segni di infezione, la terapia può infatti interrompere la malattia acuta evitando eventuali ulteriori danni anatomici. La terapia deve essere proseguita per un anno.
-
Per i primi 6 mesi deve essere somministrata l’associazione pirimetamina- sulfadiazina per via orale. La pirimetamina alla dose di 1-2 mg/Kg per 2 giorni e poi 1 mg/Kg/die per 2 mesi e successivamente 1mg/Kg/die 3 volte la settimana (lunedì, mercoledì e venerdì); la sulfadiazina alla dose di 50-100 mg/kg/die. è bene associare l’acido folinico alla dose 5-10 mg/die.
-
Nei successivi 6 mesi tale regime può essere proseguito (nei casi gravi) o può essere alternato con cicli mensili di spiramicina alla dose di 50 mg/kg/die in 2 somministrazioni orali.
Può essere utile inoltre la somministrazione di prednisone alla dose di 1 mg/kg/die in caso di corioretinite, meningoencefalite o anche di semplice iperproteinorrachia (>1000 mg/dl).
TOXOPLASMOSI E HIV
L'infezione acuta da T. gondii viene normalmente controllata dalla risposta immunitaria umorale e cellulo-mediata diretta nei confronti dei tachizoiti.
Gli anticorpi specifici opsonizzano i tachizoiti rendendoli un bersaglio per le cellule fagocitarie mononucleate che li inglobano; la lisi di queste cellule avviene poi sia direttamente sia con meccanismo anticorpo-mediato in seguito all'attivazione della via alternativa del complemento.
La risposta cellulo-mediata è più complessa e si caratterizza per la produzione di citochine (interleuchina-12 e interferone-ï§ soprattutto) che attivano le cellule difensive (monociti, macrofagi, cellule endoteliali, epiteliali e parenchimali) e le rendono capaci di uccidere i protozoi ingeriti e/o di inibire la replicazione dei microrganismi intracellulari residui.
Nei soggetti con infezione da HIV-1 la toxoplasmosi costituisce nella quasi totalità dei casi l'espressione della riattivazione di una infezione latente quando i linfociti CD4+ si riducono a valori inferiori a 100/ïl e la capacità di produrre le citochine appare ridotta rispetto alla norma; studi sperimentali hanno dimostrato il ruolo critico svolto dai linfociti CD4+ e dall'interferone-ï§ endogeno nel mantenere l'integrità delle cisti cerebrali e prevenire la loro rottura che provoca la liberazione dei tachizoiti e la formazione degli ascessi cerebrali.
L'infezione primaria è in genere rara nel paziente HIV-sieropositivo ma può occasionalmente essere riscontrata.
Nel nostro Paese la prevalenza dell'infezione da T. gondii nella popolazione adulta è del 60-70%.
Encefalite da T. gondii
L'esordio è in genere subacuto con la comparsa di alterazioni neurologiche focali nel 60-90% dei pazienti; i pazienti presentano cefalea, alterazioni dello stato mentale quali confusione, rallentamento nell'ideazione e nell'eloquio, letargia, modificazioni del comportamento che possono progredire verso quadri di psicosi franca o di coma; in un terzo dei casi il soggetto giunge all'osservazione medica per la comparsa di convulsioni.
All'esame neurologico si riscontrano deficit focali nel 60% dei casi: l'emiparesi è l'alterazione di più frequente osservazione spesso accompagnata da deficit dei nervi cranici e da altre alterazioni quali afasia, anomia, tremori, dismetria, alterazioni del campo visivo. Più raramente può essere presente una localizzazione al midollo spinale che si presenta clinicamente con quadri di mielite trasversa o di sindrome del cono midollare.
Un'altra rara modalità di presentazione è quella di una panencefalite diffusa rapidamente letale senza alterazioni neuroradiologiche dimostrabili. In taluni casi possono comparire endocrinopatie secondarie a sindrome da inappropriata secrezione di ormone antidiuretico (SIADH) o di panipopituitarismo.
L'encefalite toxoplasmica costituisce la causa più frequente di lesioni cerebrali focali nei pazienti affetti da AIDS anche se vi sono dati recenti che sembrano indicare un sopravanzamento da parte del linfoma cerebrale primitivo.
L'indagine neuroradiologica (condotta con la tomografia assiale computerizzata - TAC - o con la risonanza magnetica cerebrale - RMN) permette di identificare generalmente lesioni multiple, bilaterali, ipodense che assumo il mezzo di contrasto con aspetto "ad anello" (ring-enhancing) circondate da un importante edema perilesionale.
Le lesioni presentano un particolare predilezione per le localizzazioni ai nuclei della base e alle giunzioni cortico-midollari emisferiche ma possono localizzarsi ovunque e possono anche essere singole nel 10-30% dei casi.
L'indagine condotta con RMN si dimostra più sensibile rispetto alla TAC e permette di rilevare quasi sempre la presenza di lesioni multiple anche di piccole dimensioni (e non dimostrabili alla TAC); pertanto la presenza di una lesione singola rilevata alla RMN deve fare considerare più probabile una diagnosi di linfoma cerebrale o considerare altre possibili eziologie infettive (tubercoloma, lesioni micotiche).
Interessamento oculare
Interessamento oculare è relativamente poco frequente (rispetto alla retinite da HCMV) e può coesistere con l'encefalite nel 30-60% dei casi; si manifesta con dolore oculare e riduzione dell'acuità visiva e l'esame del fundus oculare rivela alterazioni compatibili con un quadro di retinocoroidite necrotizzante.
Le lesioni si presentano come aree focali di colorito giallo-biancastro con bordi cotonosi e possono essere bilaterali nel 18-40% dei casi; si accompagnano a neurite ottica nel 10% dei pazienti.
Poiché spesso non sono evidenti lesioni cicatriziali da precedenti localizzazioni si ritiene che questa localizzazione sia da ascrivere più verosimilmente a una disseminazione ematogena piuttosto che ad un processo di riattivazione come avviene per la localizzazione cerebrale.
Localizzazione polmonare
La localizzazione polmonare è probabilmente più frequente di quanto non si pensi e si caratterizza per la comparsa di febbre elevata, tosse e dispnea e infiltrati interstiziali indistinguibili da quelli che si osservano nella polmonite da P. carinii. Al momento della presentazione clinica è presente una localizzazione extrapolmonare nel 50% dei pazienti. In associazione con la localizzazione polmonare è stato descritto un quadro clinico che simula lo shock settico (ed è espressione di malattia disseminata) caratterizzato da ipotensione, febbre elevata, insufficienza multiorgano e livelli estremamente elevati di LDH.
Tratto da AILMI

Partita Iva: 01586190694
Laboratorio Mantoux snc
Analisi Cliniche e Microbiologiche
Viale Marconi, 57 - 66034 Lanciano (CH)
Tel. e Fax +39 0872 49877
Certificazione di Qualità - ISO 9001:2015
